Chỉ số pH phản ánh tính axit hay bazơ của một dung dịch, đóng vai trò quan trọng trong nhiều lĩnh vực từ hóa học đến đời sống. Bài viết này giúp bạn hiểu rõ pH là gì, cũng như phân biệt đúng giữa các thuật ngữ thường bị nhầm lẫn như độ pH, nồng độ pH.
Trong lĩnh vực hóa học và khoa học ứng dụng, chỉ số pH có vai trò vô cùng quan trọng và xuất hiện trong hầu hết mọi lĩnh vực từ kiểm soát chất lượng nước, đất trồng, sản phẩm tiêu dùng, đến các quá trình công nghiệp, sinh học và y tế. Dù vậy, nhiều người (nhất là newbie) vẫn thường bị nhầm lẫn giữa các khái niệm về pH, độ pH và nồng độ pH khi đọc tài liệu kỹ thuật. Bài viết sau đây sẽ cung cấp các định nghĩa để bạn hiểu rõ hơn.
Trong hóa học, pH là chỉ số đo độ hoạt động của ion hydro (H⁺) trong một dung dịch, nó được viết tắt từ “ potential of Hydrogen ”. Chỉ số này được dùng để xác định tính chất của dung dịch bất kỳ nào đó là axit, bazơ (kiềm) hay trung tính.
Công thức tính pH:
pH = -Log[H⁺]
Trong đó:
-
Log là logarit cơ số 10
-
[H⁺] là nồng độ mol ion hydro (H⁺) trong dung dịch.
Giá trị pH được tính trên thang đo từ 0 đến 14:
-
pH < 7: Dung dịch có tính axit, càng nhỏ thì tính axit càng mạnh.
-
pH = 7: Dung dịch trung tính.
-
pH > 7: Dung dịch có tính bazơ (kiềm), càng lớn thì tính bazơ càng mạnh. Ví dụ: xà phòng, xút ăn da (NaOH), nước vôi trong (Ca(OH)2),…
pH bao nhiêu là tốt?
Môi trường trung tính (pH = 7) là tốt nhất, thích hợp để mọi sinh vật phát triển. Ngược lại, chỉ số pH càng thấp nghĩa là môi trường có tính axit càng mạnh, hoặc càng cao nghĩa là môi trường có tính kiềm càng mạnh, đó đều là những môi trường độc hại.
Các yếu tố ảnh hưởng đến pH
pH của một dung dịch không phải lúc nào cũng cố định mà chịu ảnh hưởng bởi nhiều yếu tố:
-
Nhiệt độ: tăng nhiệt độ có thể làm thay đổi hằng số phân ly của nước, ảnh hưởng đến pH.
-
Nồng độ chất tan: sự thêm vào các muối, axit, bazơ ảnh hưởng trực tiếp đến [H⁺] hoặc [OH⁻].
-
CO₂ từ không khí: hòa tan vào nước tạo thành axit carbonic, làm giảm pH.
-
Tính chất dung môi: một số dung môi phi nước có thang pH khác biệt.
Độ pH là gì?
Độ pH là cách nói phổ biến để chỉ giá trị pH của một dung dịch trên thang pH dao động từ 0 đến 14. Nó là chỉ số định lượng giúp xác định mức độ axit hay bazơ và giữ vai trò quan trọng trong việc đánh giá mức độ an toàn và phù hợp của các dung dịch trong các ngành nghề và lĩnh vực đời sống.
• Độ pH thấp (0-6): dung dịch có tính axit, càng thấp thì axit càng mạnh. Ví dụ: axit clohidric (pH ≈ 1), giấm ăn (pH ≈ 3),…
• Độ pH trung bình (7): dung dịch trung tính, thường là nước tinh khiết.
• Độ pH cao (8-14): dung dịch có tính kiềm, càng cao thì kiềm càng mạnh. Ví dụ: dung dịch NaOH (pH ≈ 13), xà phòng (pH ≈ 9),…
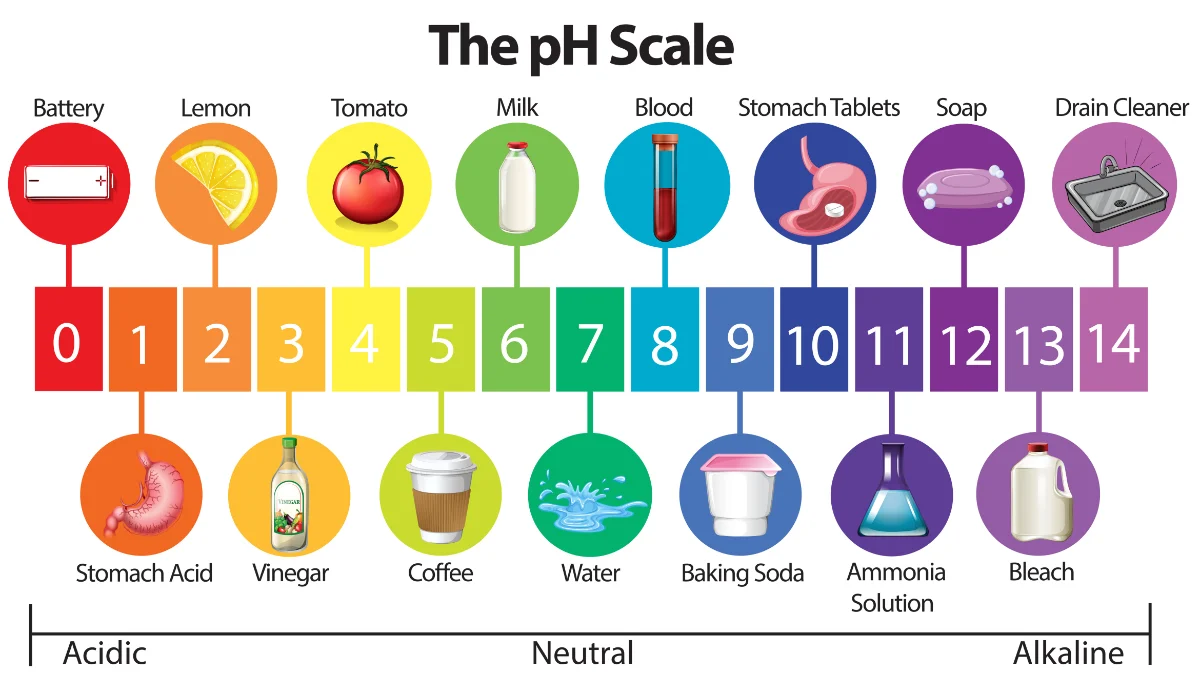
Thang đo pH. Ảnh: Jenco.
Nồng độ pH là gì?
Trên phương diện hóa học, cách gọi “ nồng độ pH ” không hoàn toàn chính xác về mặt thuật ngữ. Thay vào đó, ta nên nói là “ nồng độ ion H⁺ ” - đây mới là đại lượng thực tế được sử dụng để tính ra giá trị pH. Tuy nhiên, trong cách hiểu phổ thông, nhiều người vẫn dùng cụm từ “ nồng độ pH ” để ám chỉ độ mạnh yếu của một dung dịch axit hay bazơ, tức là mức độ axit hoặc bazơ trong dung dịch đó.
Do pH có bản chất là logarit âm của nồng độ H⁺, nên sự thay đổi nhỏ trên thang đo pH lại phản ánh sự thay đổi rất lớn về nồng độ ion. Ví dụ: pH = 3 thì [H⁺] = 10-3 mol/L; pH = 6 thì [H⁺] = 10-6 mol/L. Như vậy, pH = 3 có nồng độ H⁺ gấp 1000 lần so với pH = 6.
Như vậy,
-
pH là chỉ số biểu thị mức độ axit/bazơ của dung dịch.
-
Độ pH là giá trị đo lường cụ thể trên thang pH từ 0-14.
-
Nồng độ pH là thuật ngữ phổ thông chỉ mức độ axit/bazơ, gắn liền với nồng độ ion H⁺.
Phương pháp đo pH
Hiện nay có nhiều cách để đo pH, tùy vào mục đích sử dụng và độ chính xác yêu cầu:
1) Quỳ tím (giấy quỳ)
-
Đơn giản, nhanh chóng, dễ sử dụng.
-
Quỳ tím chuyển màu đỏ trong axit và xanh trong bazơ.
-
Không đo được giá trị chính xác – chỉ mang tính chất định tính.
2) Giấy đo pH (pH test strips)
-
Có nhiều màu sắc tương ứng với từng mức pH.
-
Cho kết quả định lượng tương đối.
-
Dùng phổ biến trong giáo dục, hồ cá, mỹ phẩm.
3) Dung dịch chỉ thị pH
-
Ví dụ: phenolphthalein, methyl orange, bromothymol blue.
-
Dùng trong phòng thí nghiệm hóa học để theo dõi phản ứng trung hòa.
4) Máy đo pH điện tử
-
Độ chính xác cao (±0.01 pH).
-
Đo được trong nhiều môi trường (nước, đất, dung dịch công nghiệp).
-
Cần hiệu chuẩn định kỳ bằng dung dịch chuẩn pH.
Như vậy, chúng ta vừa tìm hiểu rõ pH là gì, phân biệt chính xác giữa các khái niệm như độ pH, nồng độ ion H⁺, và tránh những cách diễn đạt sai lệch như “nồng độ pH” là điều cần thiết trong quá trình viết tài liệu kỹ thuật, luận văn, đề án,...
Vai trò của chỉ số pH trong đời sống hàng ngày
Ngày nay, trong bối cảnh ngày càng quan tâm đến sức khỏe, môi trường và tối ưu hóa quy trình sản xuất, việc nắm vững kiến thức về pH không chỉ là yêu cầu của chuyên gia mà còn là kiến thức nền tảng hữu ích cho tất cả mọi người. Kiểm soát tốt chỉ số này chính là một trong những yếu tố quan trọng giúp đảm bảo sự ổn định, an toàn và bền vững trong mọi lĩnh vực của đời sống hiện đại, từ đời sống hàng ngày đến công nghiệp và y học. Dưới đây là một số ứng dụng tiêu biểu:
Kiểm tra chất lượng nước
Độ pH đóng vai trò then chốt trong việc kiểm tra và đánh giá chất lượng nước sử dụng hàng ngày, bao gồm nước sinh hoạt, nước uống, hồ cá cảnh hay ao nuôi thủy sản. Cụ thể, trong nước sinh hoạt và nước uống pH giúp xác định mức độ an toàn của nước đối với sức khỏe con người; nước quá axit (pH thấp) có thể ăn mòn đường ống, giải phóng kim loại nặng như chì hoặc đồng, trong khi nước quá kiềm (pH cao) có thể gây vị lạ và ảnh hưởng đến hệ tiêu hóa. Theo Quy chuẩn kỹ thuật quốc gia về chất lượng nước uống trực tiếp (QCVN 01:2009/BYT) và các tiêu chuẩn quốc tế như của Tổ chức Y tế Thế giới (WHO), độ pH của nước uống nên nằm trong khoảng từ 6,5 đến 8,5 và nước sinh hoạt từ 6,0 đến 8,5.
Đối với ao nuôi thủy sản và hồ cá cảnh, pH là yếu tố sống còn đối với hệ sinh thái nước. Nếu lệch khỏi ngưỡng lý tưởng (từ 6,5 đến 8,5), cá và các sinh vật thủy sinh có thể bị stress, giảm khả năng hấp thụ oxy, chậm phát triển hoặc thậm chí tử vong. Do đó, bạn có thể dùng bộ test pH Sera để thuận lợi cho việc theo dõi và điều chỉnh pH định kỳ, đây là việc làm cần thiết để đảm bảo môi trường nước luôn đạt chuẩn và duy trì sự sống bền vững.
Nông nghiệp và cải tạo đất
pH trong đất đóng vai trò rất quan trọng trong nông nghiệp, vì nó ảnh hưởng trực tiếp đến khả năng hấp thụ dinh dưỡng của cây trồng, hoạt động của vi sinh vật đất và hiệu quả sử dụng phân bón. Ví dụ:
-
Khi pH thấp (đất chua): Làm giảm khả năng hấp thu các nguyên tố như canxi, magie, kali, phospho. Tăng độc tính của kim loại nặng như nhôm (Al³⁺), mangan (Mn²⁺). Ức chế vi sinh vật có lợi, ảnh hưởng đến quá trình phân giải hữu cơ.
-
Khi pH cao (đất kiềm): Làm giảm tính hòa tan của sắt, mangan, kẽm dẫn đến thiếu vi lượng và làm giảm hiệu quả của một số loại phân bón, nhất là phân lân.
Do vậy, việc cải tạo đất thường tập trung vào việc điều chỉnh pH để phù hợp với từng loại cây và điều kiện canh tác. Chẳng hạn như pH từ 5,5 đến 7,5 được xem là lý tưởng cho phần lớn các loại cây trồng; từ 6,0 - 6,5 là khoảng tốt nhất cho sự phát triển của đa số cây lương thực và cây rau màu; một số cây như trà, khoai lang, khoai tây,… có thể thích nghi với pH thấp hơn (axit hơn) và cây họ đậu hoặc cây ăn quả thường yêu cầu đất có pH cao hơn một chút (trung tính nhẹ).
Công nghiệp thực phẩm
Trong ngành thực phẩm, độ pH là một chỉ tiêu quan trọng và bắt buộc phải kiểm soát chặt chẽ, vì nó ảnh hưởng trực tiếp đến hương vị, màu sắc, độ ổn định, thời hạn bảo quản và độ an toàn vi sinh của sản phẩm.
-
Bảo quản thực phẩm: giữ pH thấp để ức chế vi khuẩn gây hư hỏng thực phẩm. Ví dụ: dưa muối, nước chanh, sốt cà chua, giấm,... Ngoài ra, một số vi khuẩn nguy hiểm như Clostridium botulinum chỉ phát triển khi pH > 4,6 nên các sản phẩm đóng hộp thường phải duy trì thấp hơn ngưỡng này.
-
Đảm bảo hương vị và màu sắc thực phẩm, ảnh hưởng đến sự cảm nhận hương vị tổng thể và tính hấp dẫn của món ăn.
-
Tác động đến cấu trúc và kết dính sản phẩm. Ví dụ: Trong chế biến sữa (sữa chua, phô mai), pH quyết định quá trình đông tụ protein (casein), hình thành kết cấu sản phẩm. Trong bánh kẹo, yếu tố này ảnh hưởng đến phản ứng Maillard và caramen hóa, từ đó ảnh hưởng đến màu và mùi.
-
Kiểm soát quy trình lên men.
Mỹ phẩm và chăm sóc da
Làn da khỏe mạnh thường có pH tự nhiên khoảng 4,5 - 5,5 tạo ra một lớp axit mantle giúp bảo vệ da khỏi vi khuẩn, nấm và các tác nhân gây hại; nó cũng giúp duy trì độ ẩm cho da và ổn định hệ vi sinh vật tự nhiên trên da. Do đó, các sản phẩm chăm sóc da thường được điều chỉnh để phù hợp với độ pH sinh lý này nhằm không làm tổn thương hàng rào bảo vệ da.
Y học và sinh học
Trong cơ thể người:
-
pH máu duy trì rất ổn định ở khoảng 7.35-7.45.
-
pH dạ dày là khoảng 1.5-3.5 để tiêu hóa thức ăn.
-
Sự mất cân bằng pH (toan máu hoặc kiềm máu) có thể dẫn đến tình trạng nguy hiểm tính mạng.
Bác sĩ thường xét nghiệm pH máu, nước tiểu để đánh giá tình trạng trao đổi chất, hô hấp, thận và chức năng gan.
Công nghiệp hóa chất và xử lý môi trường
pH là chỉ số thiết yếu trong:
-
Xử lý nước thải: pH được kiểm soát để trung hòa chất ô nhiễm trước khi xả ra môi trường.
-
Sản xuất hóa chất: nhiều phản ứng cần pH chính xác để đạt hiệu suất cao.
-
Điều chỉnh quá trình tẩy rửa, điện phân, mạ kim loại.



