H2SO4 là một trong những hóa chất nguy hiểm nhưng được ứng dụng rộng rãi trong nhiều lĩnh vực hiện nay, nó còn được biết đến với tên gọi Axit Sunfuric. Để biết thêm về loại axit này, hãy cùng KPTCHEM tìm hiểu qua bài viết sau đây nhé!
Rất ít hóa chất ảnh hưởng đến cuộc sống con người theo nhiều cách như axit sunfuric. Nó được sử dụng để sản xuất hàng nghìn sản phẩm tiêu dùng hàng ngày và được gọi là một trong các hóa chất công nghiệp quan trọng nhất.
Axit sunfuric là gì?
Axit sunfuric (còn được gọi là sulfuric acid hay hydro sulfate) là chất lỏng đậm đặc, không màu có công thức hóa học là H2SO4, khối lượng mol 98,079g/mol, mật độ phân tử 1,84 kg/L (so với nước là 1kg/L) và nhiệt độ sôi là 337°C. H2SO4 có độ sánh như dầu, đặc biệt là ở dạng cô đặc và trông giống như một loại xi-rô trong, khá nặng. Vì vẻ ngoài nhờn của nó nên nhiều năm trước đây nó còn một tên gọi khác là dầu của vitrol (hiện chỉ được dùng cho loại đậm đặc thương mại). Tuy nhiên, không giống như dầu nhờn thông thường, hóa chất sunfuric là axit mạnh có tính ăn mòn cao.
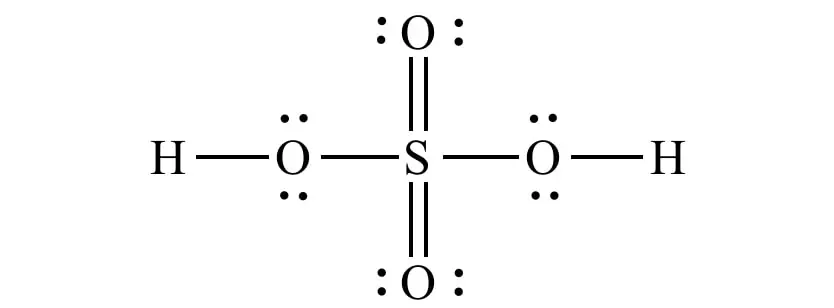
Công thức cấu tạo H2SO4. Ảnh: Internet.
Ở dạng tinh khiết nhất, dung dịch H2SO4 là chất lỏng có tính ăn mòn cao với độ pH 0,5 và có thể pha loãng với nước ở mọi nồng độ. Tiếp xúc lâu dài với nồng độ thấp hoặc tiếp xúc ngắn hạn với nồng độ cao có thể gây ảnh hưởng xấu đến sức khỏe. Axit sunfuric đậm đặc rất nguy hiểm, gây bỏng da và gây tổn thương mô nghiêm trọng khi tiếp xúc.
Vì sao H2SO4 có tính ăn mòn cao?
Hai đặc tính chung chủ yếu giải thích cho tính ăn mòn của sulfuric acid như sau:
- Đầu tiên, nó là một chất khử nước cực mạnh, kết hợp mạnh với nước. Cụ thể, khi cho H2SO4 tiếp xúc với một chất rắn bất kỳ có chứa nước hoặc không khí ẩm, nó nhanh chóng hút các phân tử nước và làm khô chất đó. Bởi vì quá trình này có thể xảy ra khá mạnh nên sẽ tạo ra phản ứng đốt cháy nhiều vật liệu hữu cơ như gỗ, giấy hoặc đường và để lại cặn cacbon.
Do đặc tính này với nước nên axit sunfuric khan tinh khiết không tồn tại trong tự nhiên. Mặc dù hoạt động núi lửa có thể tạo ra hydro sulfate và các sol khí sulfuric acid từ một vụ phun trào có thể tồn tại ở tầng bình lưu trong nhiều năm, nhưng những sol khí này sau đó có thể chuyển đổi thành SO2 - một thành phần của mưa axit.
- Đặc tính thứ hai của hợp chất hydro sunfate là xu hướng dễ dàng ion hóa. Cụ thể, trong dung dịch axit sunfuric loãng, nhóm hydro và sunfat (SO42-) tách ra, tạo thành nhiều ion hydronium và ion sunfat tích điện âm tự do có khả năng gắn vào các nguyên tử khác. Do đó, H2SO4 dễ dàng phản ứng với nhiều kim loại và cacbon, lưu huỳnh và các chất khác.
Điều chế H2SO4 như thế nào?
Axit sulfuric được sản xuất từ lưu huỳnh chủ yếu theo quy trình tiếp xúc. Tóm tắt nhanh quy trình như sau: Khi lưu huỳnh nóng chảy được đốt trong không khí tạo ra lưu huỳnh dioxide (SO2), dòng khí này sau khi hình thành phải được làm sạch và làm khô nhằm loại bỏ bụi và các tạp chất có thể gây nhiễm độc xúc tác. Tiếp theo, dòng khí được dẫn qua hệ thống tháp tiếp xúc có chứa chất xúc tác vanadi pentoxide và được oxi hóa thành lưu huỳnh trioxide (SO3) trong điều kiện nhiệt độ được kiểm soát chặt chẽ, đây là giai đoạn then chốt quyết định hiệu suất của toàn bộ quá trình. Xét về mặt nguyên tắc, lúc này có thể cho SO3 phản ứng trực tiếp với nước để tạo thành axit sulfuric, tuy vậy phản ứng này diễn ra rất mạnh, tỏa nhiều nhiệt và tạo sương axit khó kiểm soát, không phù hợp cho sản xuất liên tục quy mô lớn nên thay vào đó khí lưu huỳnh trioxide sinh ra được hấp thụ vào H2SO4 đậm đặc sẵn có để tạo oleum, sau đó oleum được pha loãng bằng lượng nước thích hợp nhằm thu được axit sulfuric có nồng độ theo yêu cầu.

Cụ thể hơn, quy trình điều chế H2SO4 được thể hiện như sau:
Bước 1: Chuẩn bị sulfur dioxide
S(s) + O2(g) → SO2 (g)
Bước 2: Điều chế sulfur trioxide
Lưu huỳnh trioxit được hình thành khi sulfur dioxide phản ứng với oxy theo tỷ lệ 1:1 ở nhiệt độ 400°C - 450°C và áp suất 1-2 atm với sự có mặt của chất xúc tác V2O5 (oxit vanadi). Phản ứng này có tính chất thuận nghịch (phản ứng xảy ra ở hai chiều ngược nhau ở cùng một điều kiện).
2SO2(g) + O2(g) ⇌ 2SO3(g)
Bước 3: Điều chế axit sunfuric đậm đặc
Lưu huỳnh trioxit hình thành lần đầu tiên được tạo ra để phản ứng với dung dịch axit sunfuric có sẵn. Sản phẩm thu được sau phản ứng này là H2S2O7 - còn gọi là oleum hay axit disulfuric hoặc axit pyrosulfuric (một lưu huỳnh oxoacid). Sau cùng, hòa tan oleum thu được vào nước để tạo thành axit sunfuric đậm đặc.
H2SO4 + SO3(g) → H2S2O7(l)
H2S2O7(l) + H2O(l) → 2H2SO4
Lưu huỳnh trioxit không thể hòa tan trực tiếp trong nước để tạo ra H2SO4 vì phản ứng này diễn ra rất mãnh liệt, tỏa nhiều nhiệt và tạo sương axit khó kiểm soát. Vì thế, phản ứng trực tiếp này chỉ được dùng trong phạm vi lý thuyết hoặc trong các thiết bị thí nghiệm đặc biệt, nơi lượng SO3 nhỏ, nhiệt lượng sinh ra có thể tản nhanh và sương axit được kiểm soát.
Cách pha loãng H2SO4 đặc an toàn
Pha loãng axit sunfuric là một thao tác thường gặp trong phòng thí nghiệm và sản xuất công nghiệp, tùy thuộc vào mục đích ứng dụng mà nồng độ của hợp chất oxy hóa mạnh này cũng có thể khác nhau. Để làm điều đó, người ta thường dùng nước để pha loãng dung dịch H2SO4 đậm đặc. Tuy nhiên, đây cũng là công việc tiềm ẩn nhiều rủi ro nếu không tuân thủ đúng quy trình. Việc hiểu và thực hiện đúng không chỉ đảm bảo an toàn mà còn giúp duy trì chất lượng dung dịch sau pha cũng như hiệu quả trong các ứng dụng thực tế.
Như đã đề cập ở trên, H2SO4 là hóa chất có tính ăn mòn cực mạnh và phản ứng mãnh liệt với nước kèm theo hiện tượng tỏa nhiệt lớn, đặc biệt là ở dạng đậm đặc. Do đó, việc pha loãng cần được thực hiện một cách có kiểm soát để đảm bảo an toàn tuyệt đối cho người thực hiện và môi trường xung quanh. Trước tiên, cần chuẩn bị đầy đủ trang bị bảo hộ cá nhân bao gồm kính bảo hộ, găng tay kháng hóa chất, áo choàng phòng thí nghiệm và mặt nạ chống khí độc nếu cần thiết. Sử dụng dụng cụ thủy tinh hoặc vật liệu chịu axit để đảm bảo an toàn. Nên thực hiện pha loãng trong tủ hút khí độc hoặc nơi thông thoáng, có hệ thống xử lý khẩn cấp.
Khi thực hiện, cần tuân thủ theo nguyên tắc quan trọng hàng đầu là: luôn cho axit vào nước rồi khuấy đều và không bao giờ được làm ngược lại. Vì sao?
- Khi axit sunfuric đậm đặc được thêm từ từ vào nước, vì hóa chất axit nặng hơn nên nó lắng xuống và nhiệt thoát ra sẽ bị tiêu tán trong nước, nhờ đó giảm thiểu nguy cơ sôi cục bộ và sẽ không xảy ra hiện tượng phun trào dung dịch ra bên ngoài. Nước khi tiếp xúc với axit đột ngột sẽ chuyển thành hơi nước do nhiệt sinh ra trong quá trình phản ứng.
- Ngược lại, nước nhẹ hơn nhiều so với hóa chất sunfuric nên nếu bạn đổ nước vào axit, nước sẽ nổi lên trên và chỉ có một khoảng trống nhỏ tại nơi nước và axit tiếp xúc với nhau. Và như bạn đã biết, ngay khi nước và axit "gặp" nhau, chúng sẽ lập tức phản ứng với nhau khiến nước sôi bùng tỏa ra nhiều nhiệt cùng hơi nước và thổi bay mọi thứ ra khỏi bình chứa.

Luôn cho H2SO4 đặc vào nước khi pha loãng để đảm bảo an toàn. Ảnh: Internet.
Dưới đây là các bước thực hiện pha loãng dung dịch H2SO4 đặc đúng quy trình, đảm bảo an toàn:
1. Trang bị đồ bảo hộ: kính bảo vệ mắt, găng tay, mặt nạ chống độc, áo choàng phòng thí nghiệm,... Bên cạnh đó, cần chuẩn bị thêm các phương án xử lý sự cố như: vòi sen, bồn rửa,... và hóa chất trung hòa axit (ví dụ natri bicacbonat).
2. Dụng cụ sử dụng: Dùng bình thủy tinh chịu nhiệt hoặc bình nhựa chuyên dụng, có khả năng chống ăn mòn bởi axit vô cơ mạnh. Chuẩn bị sẵn đũa thủy tinh hoặc máy khuấy từ gia nhiệt.
3. Tiến hành pha loãng: cho lượng nước cất vào bình pha trước. Sau đó, từ từ rót axit H2SO4 đậm đặc vào nước theo từng đợt nhỏ, vừa rót vừa khuấy đều để phân tán nhiệt. Tuyệt đối không dừng khuấy khi axit vẫn đang được thêm vào. Bạn nên thực hiện từ từ để tránh tăng nhiệt độ cục bộ quá nhanh dẫn đến sốc nhiệt gây nứt vỡ bình chứa hoặc phản ứng dữ dội. Trong suốt quá trình thực hiện, luôn giữ bình cố định và đảm bảo thông gió tốt.
4. Làm nguội và bảo quản: Sau khi pha xong, để dung dịch nguội hoàn toàn trước khi mang ra sử dụng hoặc mang đi bảo quản. Nên nhớ, bình chứa dung dịch axit sunfuric loãng phải được dán nhãn rõ ràng, bao gồm nồng độ, ngày pha, người pha và các cảnh báo an toàn cần thiết. Việc xử lý và lưu trữ cũng cần tuân thủ quy định về hóa chất nguy hiểm.
Axit H2SO4 được ứng dụng để làm gì?
Nhờ các đặc tính hóa học mạnh mẽ như tính axit cao, khả năng hút nước và tính oxy hóa mạnh, nó có thể được ứng dụng trong gia đình nhưng chủ yếu là sử dụng rộng rãi trong nhiều ngành công nghiệp, thậm chí đây còn là một trong những hóa chất công nghiệp quan trọng nhất.
Làm chất tẩy rửa trong gia đình
Với những mối nguy hiểm đi kèm tương đối lớn nên axit H2SO4 không được khuyến khích sử dụng làm chất tẩy rửa trong gia đình. Tuy nhiên, trong một số trường hợp đặc biệt, hóa chất có tính ăn mòn mạnh này chủ yếu chỉ được sử dụng trong các sản phẩm tẩy rửa dầu mỡ và nước thông cống (với mục đích ăn mòn và phân hủy nhanh rác thải hữu cơ gây tắc nghẽn giúp việc thông tắc cống tại nhà trở nên dễ dàng hơn) nhưng chỉ với hàm lượng được kiểm soát nghiêm ngặt và có cảnh báo rõ ràng. Vì đây là một hóa chất rất nguy hiểm và cần được xử lý cẩn thận.
Những lưu ý khi sử dụng axit sunfuric thông tắc cống tại nhà:
-
Cần đọc kỹ hướng dẫn sử dụng trước khi dùng.
-
Luôn mặc đồ bảo hộ thích hợp, bao gồm găng tay, kính và mặt nạ chống độc để bảo vệ bản thân khỏi các tia nước hoặc khói có thể bắn vào.
-
Thông gió: Đảm bảo căn phòng hoặc nơi cần xử lý được thông thoáng. Mở cửa sổ hoặc quạt hút để làm giảm khói độc phát sinh trong lúc thông cống.
-
Không bao giờ trộn chế phẩm chứa H2SO4 với bất kỳ hóa chất hoặc chất tẩy rửa nào khác vì điều này có thể gây ra các phản ứng hóa học nguy hiểm giải phóng khí độc hại và rủi ro cháy nổ.
-
Sơ cứu kịp thời: Nếu bị axit bắn lên người, hãy rửa sạch vùng da bị ảnh hưởng bằng nhiều nước và tìm kiếm sự chăm sóc y tế ngay lập tức.
-
Bảo quản ở nơi mát mẻ, thông gió tốt, tránh xa trẻ em, thú nuôi và các chất dễ cháy nổ. Nếu vô tình làm đổ dung dịch H2SO4 hoặc lọ đựng hóa chất bị rò rỉ, cần được làm sạch vết hóa chất đúng cách để ngăn tình trạng chảy tràn lan rộng.
Ứng dụng của H2SO4 trong công nghiệp
1. Sản xuất hóa chất
Axit sunfuric là một trong những chất nền quan trọng nhất của ngành công nghiệp hóa chất. Với các đặc tính hóa học đặc trưng, nó tham gia trực tiếp hoặc gián tiếp vào nhiều quy trình sản xuất các hóa chất cơ bản, làm chất phản ứng, chất trung gian và xúc tác trong các chuỗi tổng hợp quy mô lớn. Đơn cử như sử dụng làm nguyên liệu trung gian để tạo ra các axit hữu ích khác như axit nitric (thông qua phản ứng với muối nitrat KNO3, NaNO3) và axit clohydric (tác dụng với natri clorua). Nó cũng có thể được sử dụng để tạo ra chất tẩy rửa tổng hợp, chất màu và thuốc nhuộm cũng như muối sunfat.
2. Chế biến kim loại
Được sử dụng rộng rãi trong chế biến kim loại. Gia công kim loại là nơi kim loại được nung nóng, làm nguội và tạo hình để tạo thành bất kỳ sản phẩm nào làm từ thép, sắt hoặc đồng (ví dụ: phương tiện vận tải, linh kiện máy tính, xây dựng, đường ống, vật liệu nhà ở,…).
Axit sunfuric được sử dụng trong hỗn hợp được gọi là “tẩy thép”, là một quá trình xử lý bề mặt được sử dụng để loại bỏ bất kỳ tạp chất rỉ sét hoặc cacbon nào để hoàn thiện kim loại, là một trong những giai đoạn cuối cùng và quan trọng nhất của quá trình xử lý kim loại. Ngoài ra, nó còn được dùng để tẩy rửa kim loại trước khi mạ.
3. Sản xuất pin
Hóa chất có mã số CAS 7664-93-9 này được sử dụng kết hợp với chì để tạo ra phản ứng tạo ra đủ electron để tạo ra điện áp cần thiết cho pin lớn như ắc quy dùng cho ô tô và máy kéo. Chính vì thế, đôi khi nó còn được gọi là “axit ắc quy” và là thành phần thiết yếu để tạo ra năng lượng cho ắc quy.
4. Sản phẩm tẩy rửa gia dụng và công nghiệp
Do tính chất ăn mòn cực mạnh nên axit sunfuric là thành phần chính của nhiều sản phẩm tẩy rửa và thông tắc cống rãnh. Ngoài ra, nó còn được sử dụng để sản xuất các loại muối sunfat, chế tạo thuốc nổ, cao su và nhựa, thuốc nhuộm, giấy, tơ sợi, sơn, bình cứu hỏa, chất khử trùng,…
5. Sản xuất thuốc
-
Được sử dụng để phá hủy DNA của tế bào ung thư bằng cách sản xuất thuốc hóa trị.
-
Sản xuất thuốc an thần (Diazepam hay Valium); thuốc giảm đau, hạ sốt và chống viêm (Aspirin, Paracetamol); thuốc kháng sinh (Chloramphenicol); thuốc kháng viêm (Prednisolone); thuốc kháng khuẩn (Sulfanilamide) và Corticosteroid tổng hợp.
-
Là thành phần cơ bản của thuốc mỡ bôi ngoài da có tên Debacterol để điều trị các bệnh nhiễm trùng da khác nhau và lở loét nhiệt miệng.
6. Chế biến thực phẩm
Tại sao một axit độc hại lại được dùng trong ngành thực phẩm? Lý do là vì sulfite và sulfur dioxide giúp ngăn ngừa hư hỏng thực phẩm và sản sinh ra các chất có hại như nitrosamine. Có thể nhiều người không nhận ra, nhưng loại axit vô cơ mạnh này được ứng dụng rất phổ biến trong chế biến thực phẩm, cụ thể nó dùng để làm phá vỡ thành tế bào của rau và trái cây để chúng dễ tiêu hóa hơn, hoặc cũng có thể giúp bảo quản thực phẩm bằng cách tiêu diệt vi khuẩn hoặc nấm trước khi chúng có thể phát triển.
7. Sản xuất dầu mỏ và xăng dầu
Mặc dù không trực tiếp vào quá trình phân hủy (cracking) hydrocarbons nhưng hóa chất hydro sulfate có liên quan gian tiếp trong một số giai đoạn xử lý sau quá trình cracking để tạo thành các chất dễ quản lý hơn trước khi chúng được tinh chế thành xăng và khí đốt.
Cụ thể, dung dịch axit vô cơ mạnh này được sử dụng chủ yếu trong quy trình alkyl hóa, đóng vai trò xúc tác để tạo alkylate - thành phần xăng có chỉ số octan cao giúp nhiên liệu cháy sạch và không chứa chì. Đây là công đoạn quan trọng trong sản xuất xăng cao cấp. Nó cũng được dùng trong quá trình xử lý dầu nhằm loại bỏ tạp chất hữu cơ không bền như nhựa, hợp chất chứa nitơ,... giúp cải thiện màu sắc và độ ổn định của xăng, dầu diesel và dầu nhờn.
Ngoài ra, axit sulfuric cũng tham gia sản xuất chất hoạt động bề mặt sulfonic - là phụ gia trong nhiên liệu và dầu bôi trơn.
8. Quản lý chất thải
Rất nhiều rác thải từ quá trình sản xuất được đổ vào các bãi chôn lấp. Để trung hòa chất hữu cơ và ngăn chặn giải phóng khí độc, người ta thường sử dụng axit sunfuric cho quá trình này. Đồng thời, nó cũng đóng vai trò là chất xúc tác phá vỡ các liên kết hóa học của vật liệu. EPA đã đặt ra giới hạn về lượng hóa chất sunfuric có thể thải ra môi trường, nhưng suy cho cùng nó vẫn rất có hại cho con người.
9. Ứng dụng H2SO4 trong nông nghiệp
Ứng dụng lớn nhất của axit này trong ngành nông nghiệp là sản xuất phân bón. Cụ thể, những loại phân này được tạo ra bằng cách chiết xuất axit photphoric từ đá photphat và xử lý nó bằng hydro sunfat, kết quả tạo ra các loại phân lân vô cơ như amoni sunfat và supe lân của vôi. Phân được rải ra đồng ruộng để cung cấp dưỡng chất cho cây trồng.
Mua axit H2SO4 ở đâu uy tín tại Việt Nam?
Nếu Quý khách muốn mua axit sunfuric chất lượng với giá hợp lý để phục vụ cho quy trình sản xuất, hoặc dùng cho phòng thí nghiệm, trường học,… thì KPTCHEM sẽ là nhà cung cấp tuyệt vời cho bạn. Là một trong những đơn vị cung cấp hóa chất H2SO4 hàng đầu tại Việt Nam, với đội ngũ nhân viên có năng lực chuyên môn cao cùng hệ thống xe bồn chuyên dụng, KPTCHEM sẽ mang đến cho Quý khách sản phẩm chất lượng với chi phí tối ưu nhất. Không chỉ giao hàng trong nước, chúng tôi còn có thể vận chuyển ra nước ngoài mà vẫn đảm bảo chất lượng hóa chất tốt nhất. Hãy liên hệ ngay cho bộ phận tư vấn của chúng tôi để được hỗ trợ nhanh chóng 24/7.
FAQ
Axit sunfuric đậm đặc dùng để làm gì trong nhà máy đường?
Trong sản xuất đường mía, nước mía thô chứa nhiều tạp chất như bùn đất, chất hữu cơ, vi sinh vật, chất gây màu và muối khoáng. Để nước mía trong hơn và kết tinh đường hiệu quả, nhà máy phải điều chỉnh pH bằng cách sử dụng axit sunfuric đậm đặc được pha loãng rồi dùng để hạ pH nước mía đến mức tối ưu, giúp tạp chất dễ kết tủa và bị loại bỏ. Ngoài ra, trong các dây chuyền áp dụng công nghệ sulfit hóa, môi trường hơi acid giúp SO2 phản ứng tốt hơn, tạo màu sắc sáng và ổn định cho đường.
Trong hệ thống trao đổi ion, axit sunfuric còn được dùng để tái sinh nhựa cation khi vật liệu này mất khả năng trao đổi ion. Bên cạnh đó, sau khi sử dụng vôi để xử lý nước mía, môi trường thường trở nên quá kiềm, và H2SO4 được dùng để trung hòa lượng kiềm dư, đảm bảo an toàn và đáp ứng tiêu chuẩn môi trường.
H2SO4 làm quỳ tím chuyển màu gì?
Câu trả lời: Màu đỏ. Vì axit sunfuric là một axit mạnh, có nghĩa là nó phân ly mạnh thành các ion cấu thành của nó là ion hydro và ion sunfat. Các ion hydro này phản ứng với giấy quỳ tím chuyển sang màu đỏ.
H2SO4 loãng tác dụng với kim loại nào?
Tương tự các loại axit khác, axit sunfuric loãng phản ứng với kim loại tạo ra khí hydro và muối (kim loại sunfat). Kim loại tác dụng với H2SO4 loãng gồm: sắt (Fe), nhôm (Al), kẽm (Zn), mangan (Mn), magie (Mg).
H2SO4 loãng không tác dụng với đồng (Cu), bạc (Ag) và vàng (Au).
Vì sao Sacarozơ bị hóa đen trong H2SO4 đặc?
Axit sunfuric là axit mạnh, nó sẽ thêm một proton (H+) vào bất cứ thứ gì chấp nhận nó. Đặc biệt, nó sẽ thêm một proton vào H2O để chuyển nó thành ion hydroxonium H3O+. Đây là cách axit sunfuric loại bỏ nước và là một chất khử nước. Với carbohydrate (đường, glucose, tinh bột, xenlulo, v.v.), axit sẽ tạo ra các nhóm -OH hoặc hydroxyl hữu cơ, làm cho các nhóm hydroxyl bị loại khỏi carbon.
>> Xem video thí nghiệm phản ứng giữa đường và H2SO4 tại đây.
Khối đường có công thức phân tử là C12H22O11, giống như bất kỳ loại carbohydrate nào khác. Axit sunfuric sẽ phá vỡ các liên kết acetal trong carbohydrate. Vì vậy, kết quả là axit phân hủy đường tạo thành cacbon dioxide và nước, và phản ứng tỏa nhiệt đủ để làm bay rất nhiều hơi nước than chì màu đen.
C12H22O11 → 12C + 11H2O
Nó cũng sẽ tác động tương tự với nhiều loại tinh bột và xenlulo, cũng như da người. Đó là lý do vì sao việc sử dụng axit sunfuric là cực kỳ nguy hiểm và cần phải trang bị đồ bảo hộ khi tiếp xúc, sản xuất, thí nghiệm.



