Khi nhắc đến các loại axit mạnh trong hóa học, nhiều người sẽ nghĩ ngay đến axit sulfuric, nhưng ít ai biết rằng axit nitric - với công thức HNO3 - cũng là một cái tên “quyền lực” không kém. Bài viết này sẽ cung cấp cho bạn kiến thức toàn diện về hợp chất này!

Dung dịch axit nitric tinh khiết trong phòng thí nghiệm. Ảnh: Shutter Stock.
Không chỉ nổi bật nhờ tính ăn mòn và oxy hóa mạnh, axit nitric còn góp mặt trong vô số lĩnh vực quan trọng như sản xuất phân bón, chất nổ, dược phẩm, thậm chí là trong nghiên cứu khoa học. Vậy điều gì khiến hợp chất này được sử dụng rộng rãi đến vậy?
Axit Nitric là gì? Định nghĩa và tính chất
-
Công thức hóa học: HNO3
-
Khối lượng mol: 63,01 g/mol
-
Phân loại: Axit một nấc (chỉ có một ion H⁺ có thể tách ra trong dung dịch nước)
Axit nitric là một hợp chất hóa học có công thức HNO3, thuộc nhóm axit vô cơ mạnh. Trong điều kiện tiêu chuẩn, nó là dung dịch lỏng không màu, dễ bay hơi, có mùi hăng mạnh và rất dễ hút ẩm. Khối lượng riêng khoảng 1,51 g/cm³, nhiệt độ sôi khoảng 83°C và nhiệt độ nóng chảy khoảng -42°C. Tuy nhiên, hợp chất này dễ bị phân hủy, đặc biệt khi tiếp xúc với ánh sáng hoặc nhiệt độ cao, sự hình thành của khí nitơ dioxit (NO2, có màu nâu đỏ) khiến dung dịch chuyển sang màu vàng nhạt hoặc nâu.
Khi hòa tan trong nước tạo thành dung dịch axit nitric có tính ăn mòn cao và khả năng oxy hóa mạnh, có thể phản ứng với nhiều kim loại và hợp chất hữu cơ. Nhờ các đặc tính này mà nó được ứng dụng rộng rãi trong nhiều lĩnh vực khác nhau.
Xét về cấu trúc phân tử, HNO3 gồm một nguyên tử hydro, một nguyên tử nitơ và ba nguyên tử oxy. Trong đó, nitơ nằm ở trung tâm, liên kết với ba nguyên tử oxy theo cấu trúc cộng hóa trị, một trong số đó hình thành liên kết đôi. Cấu trúc này thể hiện tính axit mạnh và tính oxy hóa cao làm cho nó trở thành một chất phản ứng rất mạnh trong các phản ứng hóa học và là một trong những hóa chất công nghiệp không thể thay thế. Đơn cử, axit nitric tinh khiết có khả năng phản ứng với hầu hết kim loại (trừ vàng và platin):
-
Oxy hóa kim loại tạo muối nitrat và khí NO, NO₂
-
Tác dụng với phi kim như lưu huỳnh, photpho, carbon
-
Phản ứng với hợp chất hữu cơ để tạo ra các dẫn xuất nitro
Ví dụ: Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O

Khi tiếp xúc với nhiệt độ cao, lọ đựng dung dịch HNO3 ngả sang màu vàng nhạt. Ảnh: Shutter Stock.
Cách điều chế
Axit nitric được điều chế chủ yếu bằng phương pháp Ostwald - một quy trình công nghiệp hiện đại sử dụng amoniac NH3 làm nguyên liệu chính, qua phản ứng oxy hóa xúc tác để tạo thành nitơ oxit và từ đó tạo ra HNO3. Quá trình điều chế được thể hiện qua các phương trình phản ứng như sau:
4NH3 + 5O2 → 4NO + 6H2O
2NO + O2 → 2NO2
3NO2 + H2O → 2HNO3 + NO
-
Axit nitric tinh khiết (thường trên 99%) chủ yếu dùng trong nghiên cứu, phân tích hóa học hoặc sản xuất vi điện tử, đòi hỏi độ tinh khiết cao.
-
Ở cấp độ thương mại, dung dịch pha loãng của nó có nồng độ khác nhau. Trong đó, phổ biến từ 55% đến 68% được sử dụng rộng rãi trong công nghiệp.
Tùy theo mục đích sử dụng, người dùng cần chọn loại axit với nồng độ phù hợp và tuân thủ các biện pháp an toàn đi kèm.
Axit nitric độc hại như thế nào?
Trong hóa học, HNO3 được biết đến là một axit mạnh với khả năng oxy hóa mạnh, phản ứng nhanh với nhiều kim loại và hợp chất hữu cơ. Vì vậy, nó cũng mang lại nhiều nguy cơ tiềm ẩn nếu không sử dụng đúng cách, nhất là khi tiếp xúc trực tiếp hoặc hít phải hơi của nó. Dưới đây là những ảnh hưởng cụ thể mà bất kỳ ai cũng có thể gặp phải khi làm việc với hóa chất này:
- Độc hại với sức khỏe con người:
-
Trên da: Gây bỏng rát nghiêm trọng, ăn mòn mô, để lại vết thương lâu lành và có thể để sẹo. Da tiếp xúc lâu có thể chuyển màu vàng do phản ứng với protein.
-
Với mắt: Có thể gây tổn thương mắt nghiêm trọng hoặc mù lòa nếu không được xử lý kịp thời.
-
Đường hô hấp: Hơi hóa chất rất độc, có thể gây kích ứng mạnh niêm mạc mũi, họng, phổi, dẫn đến ho, khó thở, viêm phế quản. Hít phải lượng lớn có thể gây phù phổi cấp, nguy hiểm đến tính mạng.
-
Nếu vô tình uống phải, tính ăn mòn mạnh của nó sẽ gây bỏng nặng đường tiêu hóa, đau bụng dữ dội, nôn ra máu và có thể gây tử vong nếu không cấp cứu kịp thời.
- Ảnh hưởng đến môi trường:
-
Là chất oxy hóa mạnh nên nitric acid có thể phản ứng với nhiều chất hữu cơ trong môi trường, gây cháy hoặc tạo chất độc khác.
-
Khi thải ra ngoài không đúng cách, nó gây ô nhiễm nguồn nước, đất, và ảnh hưởng xấu đến hệ sinh thái. Khí NO2 sinh ra từ phân hủy hợp chất HNO3 thuộc nhóm khí thải NOx - thành phần quan trọng gây ô nhiễm môi trường và là một trong những nguyên nhân gây mưa axit và hiệu ứng nhà kính.
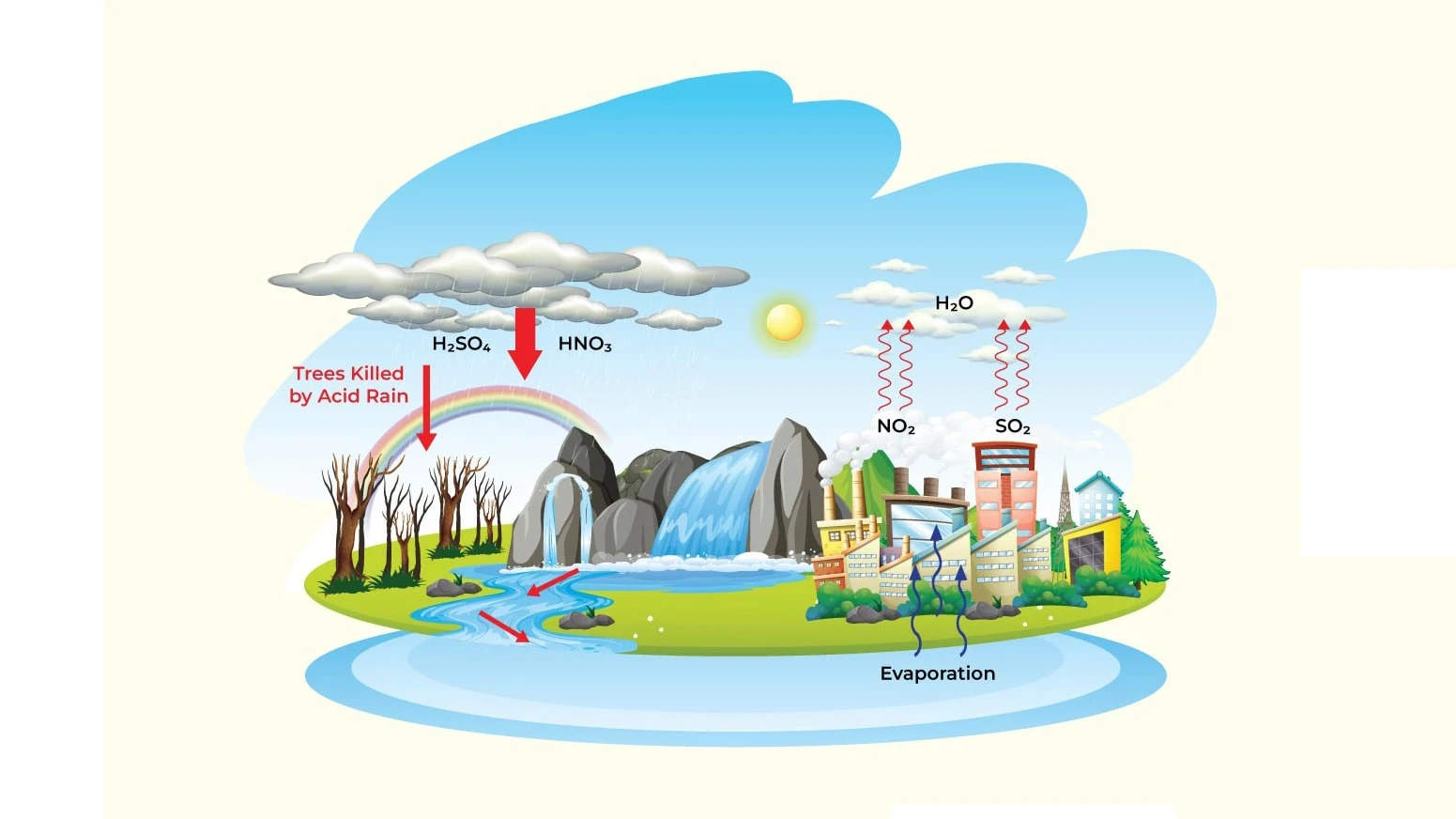
Là một trong những hóa chất công nghiệp quan trọng, song, hợp chất HNO3 cũng gây ra nhiều nguy hại cho sức khỏe con người và môi trường - mưa axit là một thí dụ điển hình. Ảnh: Studymat.
Ứng dụng của HNO3 trong thực tiễn
Mặc dù là một hóa chất nguy hiểm nhưng HNO3 lại là một trong những hợp chất vô cơ quan trọng và được sử dụng rộng rãi trong công nghiệp hiện đại. Ứng dụng của dung dịch lỏng có tính axit mạnh này rất đa dạng và có mặt trong nhiều ngành công nghiệp sản xuất cốt lõi từ phân bón, thuốc nổ đến luyện kim và tổng hợp hóa học. Cụ thể:
Nông nghiệp
Một trong những ứng dụng lớn nhất và phổ biến nhất của HNO3 là được dùng trong sản xuất phân đạm, đặc biệt là phân amoni nitrat (NH4NO3), giúp cung cấp nguồn nitơ dễ hấp thụ cho cây trồng và tăng năng suất.
Bên cạnh đó, hợp chất vô cơ có tính axit mạnh này còn được dùng để điều chỉnh độ pH trong dung dịch dinh dưỡng thủy canh hoặc hệ thống tưới nhỏ giọt, giúp cây hấp thụ dưỡng chất hiệu quả hơn. Nhờ có khả năng cung cấp thêm ion nitrat (NO3⁻) nên nó không chỉ điều chỉnh môi trường mà còn bổ sung dinh dưỡng hữu ích cho cây.
Ngoài ra, trong các hệ thống tưới nhỏ giọt, dung dịch axit nitric loãng còn được dùng để tẩy cặn, làm sạch ống tưới giúp giảm nghẹt đầu tưới do muối khoáng tích tụ, nâng cao hiệu quả vận hành trong canh tác nông nghiệp hiện đại.
Chất nổ
Axit nitric là một nguyên liệu quan trọng trong sản xuất các loại chất nổ như nitroglycerin, TNT (trinitrotoluene) nhờ khả năng nitrat hóa - tức là gắn nhóm nitro (-NO2) vào các hợp chất hữu cơ để tạo các dẫn xuất có khả năng phát nổ cao.
Khi kết hợp với axit sunfuric (H2SO4), nitric acid tạo ra hỗn hợp nitrat hóa cực mạnh, có thể tác dụng với các chất như glycerol, cellulose hoặc toluen để tạo ra các chất nổ như nitroglycerin, nitrocellulose và trinitrotoluen (TNT). Những chất nổ này được ứng dụng rộng rãi trong công nghiệp khai thác, quốc phòng và chế tạo đạn dược. Vì thế, hợp chất này cần được kiểm soát nghiêm ngặt trong lưu trữ và sử dụng để đảm bảo an toàn và tránh nguy cơ lạm dụng.
Luyện kim và công nghiệp điện tử
Nhờ khả năng ăn mòn và làm sạch hiệu quả, axit nitric trở thành hóa chất không thể thiếu trong nhiều công đoạn sản xuất hiện đại (nhất là trong lĩnh vực luyện kim và công nghiệp điện tử), dù cần được sử dụng cẩn trọng để tránh ảnh hưởng đến thiết bị và môi trường.
Cụ thể, trong luyện kim hợp chất vô cơ có tính axit mạnh này được sử dụng để làm sạch bề mặt kim loại, loại bỏ các lớp oxit, gỉ sét hoặc tạp chất trước khi mạ, hàn hoặc gia công. Nó còn được dùng trong quá trình tách và tinh chế kim loại quý như vàng, bạc, đặc biệt khi kết hợp với axit clohydric (HCl) để tạo ra nước cường toan, có thể hòa tan cả vàng và bạch kim.
Trong công nghiệp điện tử, dung dịch HNO3 được sử dụng để rửa mạch in (PCB), làm sạch bề mặt linh kiện và loại bỏ kim loại không mong muốn trong vi xử lý. Ngoài ra, nó còn góp phần vào quá trình sản xuất chất bán dẫn, giúp xử lý bề mặt đĩa bán dẫn (wafer silicon) và loại bỏ các chất ô nhiễm cực nhỏ, đảm bảo độ tinh khiết cao cho linh kiện vi mạch.
Trong phòng thí nghiệm
Axit nitric tinh khiết là một trong những hóa chất thí nghiệm được sử dụng phổ biến trong các phòng thí nghiệm nhờ tính oxy hóa cao và khả năng phản ứng mạnh với kim loại, bazơ, oxit và muối. Nó thường được dùng để chuẩn độ trong phân tích hóa học, đặc biệt là trong các phản ứng axit-bazơ. Ngoài ra, nó còn được sử dụng để tạo nitrat kim loại, phục vụ cho nghiên cứu phản ứng và điều chế chất mới.
Trong hóa phân tích, nó đóng vai trò quan trọng trong việc hòa tan mẫu kim loại, đặc biệt là trong phân tích định lượng hoặc chuẩn bị mẫu cho các thiết bị phân tích hiện đại như AAS (quang phổ hấp thụ nguyên tử) hay ICP-MS.
Ngoài ra, hợp chất này cũng được ứng dụng vào mục đích tẩy rửa dụng cụ thủy tinh hoặc loại bỏ chất bẩn hữu cơ, thường bằng hỗn hợp axit nitric và axit sulfuric, giúp làm sạch dụng cụ một cách triệt để trước các thí nghiệm yêu cầu độ tinh khiết cao.
Tuy nhiên, do tính ăn mòn và độc hại, việc sử dụng HNO3 trong phòng thí nghiệm cần tuân thủ nghiêm ngặt các quy tắc an toàn, bao gồm sử dụng tủ hút, đồ bảo hộ và bảo quản đúng cách.
Dược phẩm và dệt nhuộm
Tuy không phải là hóa chất chính trong hai ngành này, nhưng axit nitric vẫn đóng vai trò hỗ trợ không thể thiếu trong các công đoạn xử lý nguyên liệu và tổng hợp hóa chất chuyên dụng. Một số loại thuốc, thuốc nhuộm, sơn cũng cần đến sự tham gia của hợp chất này trong quá trình tổng hợp.
Cụ thể, ứng dụng của HNO3 trong lĩnh vực dược phẩm là chất trung gian trong tổng hợp hóa học, giúp tạo ra các hợp chất nitrat hữu cơ - một số trong đó có tác dụng sinh học. Ví dụ, một số dẫn xuất nitrat được dùng trong điều trị tim mạch như nitroglycerin có tác dụng giãn mạch và điều trị đau thắt ngực. Ngoài ra, hóa chất này còn được dùng trong sản xuất và tinh chế nguyên liệu dược, đặc biệt là những hợp chất yêu cầu độ tinh khiết cao.
Trong ngành dệt nhuộm, hợp chất thuộc nhóm axit vô cơ mạnh này được sử dụng để xử lý và làm sạch sợi, loại bỏ tạp chất hữu cơ và tăng khả năng bám màu của sợi vải. Nó cũng được dùng để tạo ra thuốc nhuộm azo (một trong những nhóm màu quan trọng và phổ biến nhất trong ngành dệt). Nhờ khả năng phản ứng mạnh, HNO3 giúp cải thiện chất lượng màu sắc, độ bền màu và tính đồng đều trong quá trình nhuộm vải.

Mặc dù là một hóa chất nguy hiểm nhưng axit nitric lại là một trong những hợp chất vô cơ quan trọng và được sử dụng rộng rãi trong công nghiệp hiện đại. Ảnh: Alliancechemical.
Cách bảo quản axit nitric và những quy tắc an toàn khi sử dụng
Axit nitric HNO3 là hóa chất mạnh, dễ bay hơi và phân hủy tạo khí NO2 khi tiếp xúc với ánh sáng hoặc nhiệt độ cao, vì vậy cần được bảo quản cẩn thận để đảm bảo an toàn và giữ chất lượng. Việc bảo quản đúng cách không chỉ giúp duy trì chất lượng của hóa chất mà còn đảm bảo an toàn cho người sử dụng và môi trường làm việc. Dưới đây là các nguyên tắc bảo quản đúng cách:
1. Sử dụng chai thủy tinh tối màu hoặc chai nhựa fluor (như PTFE), có nắp kín để chứa dung dịch axit nitric nhằm tránh ánh sáng và không khí lọt vào.
2. Tránh ánh sáng trực tiếp, cần đặt hóa chất ở nơi râm mát, tránh ánh sáng mặt trời, tốt nhất là trong tủ hóa chất chuyên dụng.
3. Bảo quản nơi nhiệt độ phòng ổn định, thoáng khí, tránh nơi ẩm thấp hoặc gần nguồn nhiệt. Không để gần các thiết bị phát tia lửa, tia UV.
4. Không được để gần các chất dễ cháy, chất hữu cơ, kim loại nhẹ hoặc các chất có tính khử mạnh như đường, cồn, bột nhôm, vì có thể gây phản ứng cháy nổ.
5. Ghi đầy đủ tên hóa chất, nồng độ, cảnh báo nguy hiểm và ngày mở nắp lên nhãn để dễ kiểm soát trong quá trình sử dụng.
6. Khi làm việc với hóa chất, luôn đeo dụng cụ bảo hộ chuyên dụng như găng tay chống hóa chất, mặt nạ chống độc, kính bảo hộ, khẩu trang. Làm việc trong phòng thông gió tốt hoặc sử dụng trong tủ hút khí độc với khung cửa sổ được đặt ở độ cao thích hợp để hạn chế tiếp xúc với hơi độc.
7. Khi hóa chất bắn lên người, cần rửa sạch khu vực tiếp xúc và nhanh chóng đến cơ sở y tế nếu cần.
8. Thu gom chất thải axit nitric vào thùng chứa được chỉ định phù hợp với nồng độ của hóa chất. KHÔNG sử dụng chai đựng dung môi hữu cơ rỗng.
Qua bài viết trên đây, có thể thấy Axit nitric là một hóa chất không thể thiếu trong nhiều lĩnh vực của đời sống và sản xuất. Từ nông nghiệp, công nghiệp hóa chất đến luyện kim và nghiên cứu khoa học, ứng dụng của HNO3 ngày càng đa dạng. Tuy nhiên, tính ăn mòn và độc tính cao của hợp chất này đòi hỏi người sử dụng phải nắm vững kiến thức và kỹ năng an toàn trong quá trình sử dụng.
Việc hiểu rõ về công thức, tính chất, cách sử dụng và bảo quản không chỉ giúp phát huy tối đa hiệu quả ứng dụng mà còn góp phần bảo vệ sức khỏe và môi trường sống. Đây là lý do tại sao mỗi cá nhân hoặc doanh nghiệp tiếp xúc với hóa chất này đều cần được đào tạo và trang bị đầy đủ thông tin trước khi đưa vào sử dụng thực tiễn.



